亲水作用色谱联用质谱 (Byos®)
在腺相关病毒衣壳蛋白表征中的应用
Anita P.Liu、Shailin K.Patel、Tao Xing、Youtian Yan、Shunhai Wang and Ning Li,Regeneron Pharmaceuticals Inc.,Tarrytown,NY,USA
本应用说明概述了我们的研究。
完整研究可通过 Journal of Pharmaceutical and Biomedical Analysis 网站在线访问。
【优势总结】
本文介绍了一种快速、可靠且灵敏的方法用于确认腺相关病毒 (AAV) 血清型,结合了HILIC分离、荧光检测、精确质量数测定及自动化数据分析。
通过完整衣壳蛋白的分离提供全面表征,以确认血清型种类并评估衣壳蛋白的化学计量和完整性,从而扩展产品知识并确保产品与工艺的一致性。
使用 Byos®进行完整质量分析,确保蛋白组成及其亚型能够准确去卷积并自动定量。
摘要
重组AAV载体因其低免疫原性和低细胞毒性,并能有效转导多种细胞类型,正日益广泛作为基因递送工具用于靶向多种人类疾病[1]。根据目标疾病的不同,需要仔细评估AAV血清型以实现所需的病毒感染性,因为不同血清型表现出不同的组织和细胞嗜性特征[2]。
除了天然存在的AAV血清型外,工程化血清型的数量也在迅速增加,其衣壳氨基酸序列和结构的差异有助于与各种宿主细胞受体的优先相互作用。
为了支持基于AAV的基因治疗开发,我们发现对重组AAV的三种衣壳病毒蛋白(VP; VP1/VP2/VP3) 进行表征,可以深入了解衣壳种类、异质性以及产品和工艺一致性。本文中使用 Protein Metrics 的 Byos 软件平台对原始数据进行表征和分析,提供了高度可靠的结果。
简介
我们开发了一种新型完整蛋白质质量分析方法,用于表征AAV衣壳蛋白。该方法利用了亲水作用色谱 (HILIC) 的独特选择性,并结合了荧光 (FLR) 和质谱检测 (HILIC-FLR-MS)。与反相液相色谱 (RPLC) 相比,我们证明了 HILIC 方法能够更有效地从多种 AAV 血清型中分离三种VP,便于化学计量分析。此外,该方法还能够分离经氧化和磷酸化修饰的衣壳蛋白变异体,这是AAV衣壳中常见的两种PTM。
方法
液相色谱分离在配备光电二极管阵列 (PDA) 检测器和荧光(FLR)检测器的Waters I-Class UPLC系统 (Waters, Milford, MA, USA) 上进行。对于HILIC分离,每种AAV样品取1~3 μL,通过直接进样 (1 μL) 或采用上样策略 (>1 μL) 进样至Waters ACQUITY UPLC BEH糖蛋白分析专用柱 (300 Å, 1.7 μm, 2.1 × 150 mm)。
对于RPLC分离,每种AAV样品取3 μL进样至Waters ACQUITY UPLC BEH C4蛋白分析专用柱(300 Å, 1.7 μm, 2.1 × 150 mm)。对于 UV 检测,波长设定为 280 nm。对于FLR 检测,采用的激发(Ex) 波长和发射 (Em) 波长分别为 280 nm 和 348 nm。质谱分析在Q-Exactive Plus Orbitrap 质谱仪(Thermo Fisher Scientific, Bremen, Germany) 上进行。为了抵消 TFA 引起的离子抑制效应,离子源中添加了脱溶剂气改性装置,以 3:1 (v/v) 的丙酸(PA) 和异丙醇 (IPA) 比例输送掺杂气体。使用 Protein Metrics Inc. (Cupertino, CA, USA) 的Byos 软件对原始MS数据进行去卷积。
结果与讨论
01
HILIC和RPLC在AAV衣壳蛋白分离中的比较
HILIC 的保留机制较为复杂,主要基于分析物在高有机含量流动相和固定相上富集的水层之间的分配[3, 4]。在生物制药实验室中,基于HILIC的分离方法常用于研究糖基化蛋白质生物制药中释放的聚糖或糖肽。基于 HILIC 的完整蛋白质质量方法已被用于表征治疗性单克隆抗体 (mAb) 中的糖基化谱图和产品相关低分子量杂质 (LMW)[5, 6]。
我们研究了HILIC方法是否能够优于常用的RPLC方法对 AAV 衣壳蛋白进行分离。为了进行比较,在FLR和MS检测之前,使用BEH C4蛋白分析专用柱通过RPLC 或使用BEH糖蛋白分析专用柱通过HILIC分离三种AAV血清型 (AAV6、AAV7和AAV8) 的衣壳蛋白。与之前的报告一致,即使对梯度进行了广泛优化,对于所有三种血清型,C4 柱分离也只能分离出两个色谱峰。
后续的MS分析确认了第一个峰中VP1和VP2共洗脱,随后是VP3,如图1B所示。相比之下,相同AAV血清型的HILIC分离显示每种血清型存在多个分离或部分分离的峰,均通过MS分析进行鉴别。对于三种血清型,均先洗脱VP3,然后VP2,最后是VP1。有趣的是,尽管VP1包含VP2的完整序列,但其在HILIC色谱柱上的洗脱顺序总是早于VP2,表明其独特的N端具有相对较高的疏水性。此外,HILIC-FLR-MS分析还发现了几种变异体峰,这些变异体峰归因于单个衣壳蛋白上发生的氧化和磷酸化。由于亲水性增强,这些变异体成分在HILIC色谱柱上的保留性更强,洗脱时间略晚于未修饰的对应物。虽然尚不清楚衣壳蛋白氧化如何影响基于AAV的制剂的效力,但从过程控制的角度监测这一属性仍然很重要。此外,之前的研究显示酪氨酸磷酸化会对AAV2载体的转导效率产生负面影响[7],这表明磷酸化可能是基于 AAV 的药物开发中的关键质量属性。最后,AAV6的HILIC-FLR-MS分析还显示了一个在VP3之前洗脱的部分分离峰,后续鉴定为VP3的N端片段,该片段由于蛋白质骨架在Pro210和Met211之间发生剪切,随后发生N端Met丢失和丙氨酸乙酰化而形成 (图 1A,第三条迹线)。因此,HILIC 方法在分离AAV衣壳蛋白及其变异体形式方面明显优于RPLC方法。
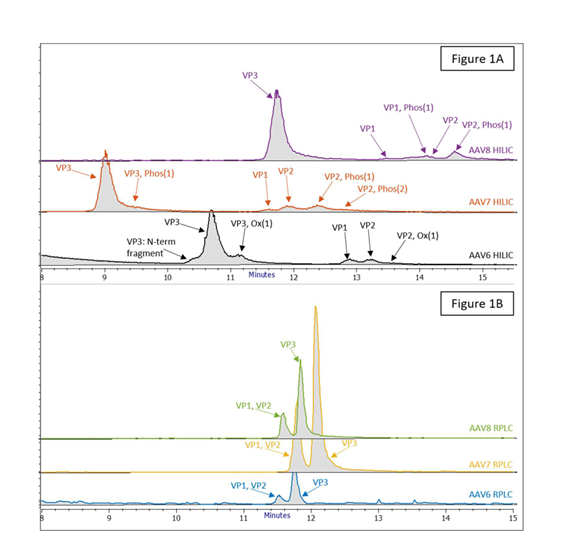
图1.使用以下配置对 AAV6(下图)、AAV7(中图)和 AAV8(上图)衣壳蛋白 (VP) 的 LC-MS TIC 图谱进行比较:(a) Waters ACQUITY UPLC BEH 糖蛋白分析柱 (300 Å, 1.7 μm, 2.1 mm × 150 mm),(b) Waters ACQUITY UPLC BEH C4 蛋白分析柱 (300 Å, 1.7 μm, 2.1 mm × 150 mm)。通过精确质量测定确认并注释峰的归属。Ox:氧化;Phos:磷酸化[1]
02
HILIC-FIR-MS在多种AAV血清型中的广泛应用
为了验证其普遍适用性,我们将HILIC-FLR-MS技术应用于多种AAV血清型(AAV1、AAV2、AAV6、AAV7、AAV8、AAV9、AAVDJ 和AAVhu37) 的衣壳蛋白表征。通过比较实测质量数与预测质量数,针对质量数误差小于 2 Da 的3种独特衣壳蛋白,明确确认了各AAV血清型。此外,质量数误差小于4 Da的PTM变异体或蛋白质骨架剪切产生的衣壳蛋白变异体也得到了可靠鉴定。MS分析表明,VP1和VP3中的N端甲硫氨酸被去除,并对后续丙氨酸进行了乙酰化,同时所有血清型的 VP2中N端苏氨酸也被去除。此外,大多数AAV血清型样品中还鉴定出氧化和磷酸化变异体。
由于亲水性的增加,这些变异体在HILIC色谱柱上的保留性增强,从而与未修饰的衣壳蛋白有效分离。值得注意的是,色谱分离步骤有助于检测这些低丰度变异体的MS信号,不仅降低了共洗脱物质的离子抑制效应,还能精确测定质量数变化较小的变异体的质量。该HILIC方法还能够分离衣壳蛋白片段。
AAVDJ的分析显示了两个低丰度、早期洗脱的FLR峰,分别由于Gly454和Gly455或Asn458和Thr459之间的蛋白质骨架剪切生成,被鉴定为VP3的N端和C端片段。尽管如此,该HILIC方法仍可用于半定量比较来自不同批次或工艺的3种VP的相对表达水平,如图2中的堆积条形图所示。
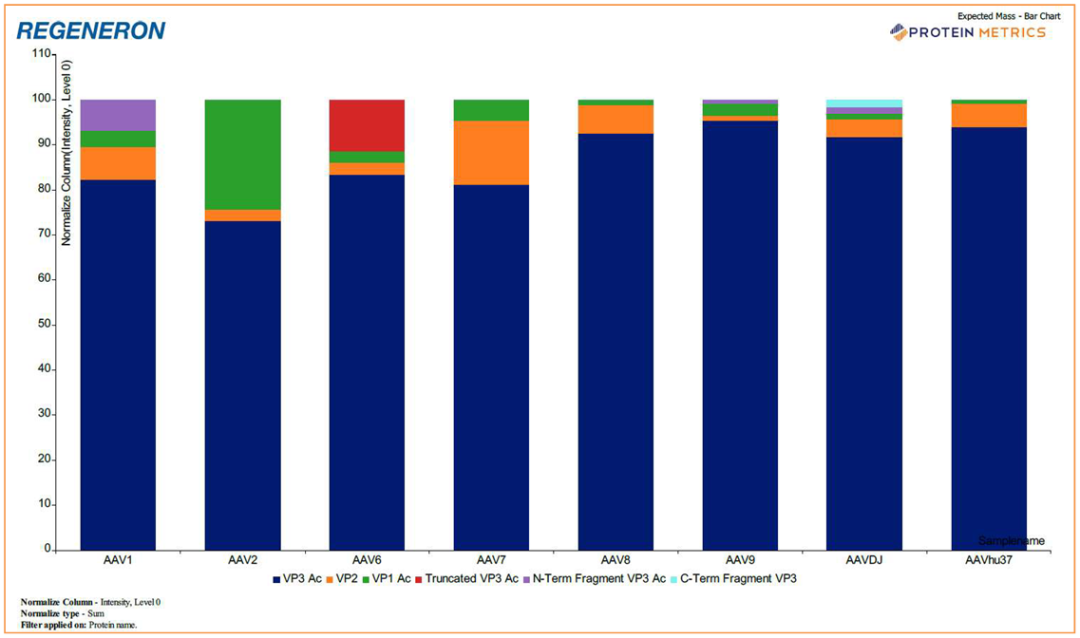
图2. 根据 AAV 血清型(AAV1、AAV2、AAV6、AAV7、AAV8、AAV9、AAVDJ 和 AAVhu37)的 HILIC-MS 分析自动生成的蛋白质指标报告归一化图。根据各样品的总强度对 MS 强度 (EU) 进行归一化。
03
应用HILIC-FLR-MS进行批次间比较
一项可比性案例研究验证了HILIC-FLR-MS方法的实用性,通过比较在衣壳蛋白水平上采用两种不同工艺生产的两个AAV8批次在比较FLR图谱时可以明显看出,尽管两个批次的 FLR 主峰 (VP3) 显示出相同的保留时间,但整体图谱中存在显著差异。随后,对每个 FLR 峰的质谱信号进行了平均和去卷积处理,如图 3 所示。
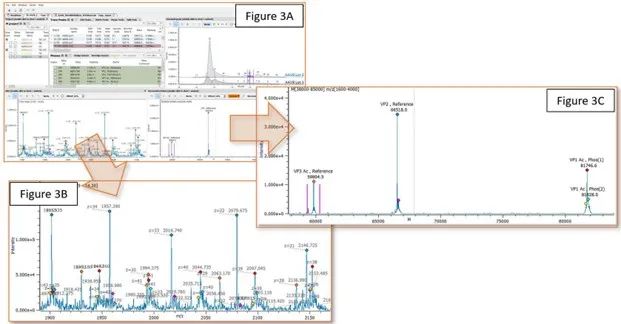
图3.Byos 项目展示了 AAV8(批次 1 和 2)的 HILIC-FLR-MS 色谱图比较(图 3A)。对两个样品的荧光强度(EU,右上 3A)进行了归一化[1]。通过精确质量测定确认了 FLR 峰的归属结果,并进行了注释。Ox:氧化;Phos:磷酸化。彩色点:图 3B(原始数据)清楚标记了 AAV8 批次 1 中选取峰的去卷积质谱所对应的 m/z 值,每个 m/z 上方都有一个彩色点。在去卷积质谱图中,使用相同的圆点标记相应的去卷积质量数(图 3C)
结论
随着基于AAV的基因疗法在制药市场的快速发展,对支持产品和工艺开发的改良分析方法的需求也在不断增加。在此,我们开发了一种HILIC-FLR-MS方法,该方法通常可通过Byos软件对多种AAV血清型的衣壳蛋白进行表征,实现明确的血清型鉴定、化学计量评估和PTM表征。
与肽图分析相比,该方法虽然无法揭示位点特异性的 PTM 信息,但具有更高的通量和更少的样品处理要求,尤其在需要及时评估大量样品的工艺开发中具有重要的应用价值。
有关色谱和完整质量数据分析工作流程的更多资源和背景信息,请访问
https://www.proteinmetrics.com/workflows/
或通过support@proteinmetrics.com 联系客户成功团队。
参考文献
[1] R.J. Samulski, N. Muzyczka, AAV-Mediated Gene Therapy for Research andTherapeutic Purposes, Annu. Rev. Virol. 1 (1) (2014) 427–451.
[2] S. Pipe, F.W.G. Leebeek, V. Ferreira, E.K. Sawyer, J. Pasi, Clinical considerationsfor capsid choice in the development of liver-targeted AAV-based genetransfer, Mol. Ther. Methods Clin. Dev. 15 (2019) 170–178.
[3] H. Song, E. Adams, G. Desmet, D. Cabooter, Evaluation and comparison of thekinetic performance of ultra- high performance liquid chromatography andhigh-performance liquid chromatography columns in hydrophilic interactionand reversed-phase liquid chromatography conditions, J. Chromatogr. A 1369(2014) 83–91.
[4] A. Periat, S. Fekete, A. Cusumano, J.L. Veuthey, A. Beck, M. Lauber, D.Guillarme, Potential of hydrophilic interaction chromatography for theanalytical characterization of protein biopharmaceuticals, J. Chromatogr. A1448 (2016) 81–92.
[5] S. Wang, A.P. Liu, Y. Yan, T.J. Daly, N. Li, Characterization of product-relatedlow molecular weight impurities in therapeutic monoclonal antibodies usinghydrophilic interaction chromatography coupled with mass spectrometry, J.Pharm. Biomed. Anal. 154 (2018) 468–475.
[6] E. Dominguez-Vega, S. Tengattini, C. Peintner, J. van Angeren, C. Temporini, R.Haselberg, G. Massolini, G.W. Somsen, High-resolution glycoform profiling ofintact therapeutic proteins by hydrophilic interaction chromatography-massspectrometry, Talanta 184 (2018) 375–381.
[7] L. Zhong, B. Li, G. Jayandharan, C.S. Mah, L. Govindasamy, M.Agbandje-McKenna, R.W. Herzog, K.A. Weigel- Van Aken, J.A. Hobbs, S.Zolotukhin, N. Muzyczka, A. Srivastava, Tyrosine-phosphorylation of AAV2vectors and its consequences on viral intracellular trafficking and transgeneexpression, Virology 381 (2) (2008) 194–202.
关于Protein Metrics
Protein Metrics LLC是一家全球领先的质谱数据解析软件供应商,公司总部位于美国波士顿。我们为科研和企业用户提供高效准确的一站式质谱数据解析方案,帮助用户发现、解决问题。Protein Metrics在全球范围内提供销售和支持,目前已为超过200个企业和300个科研单位提供服务。
联系我们邀约展示:
王蕾 13482181958

