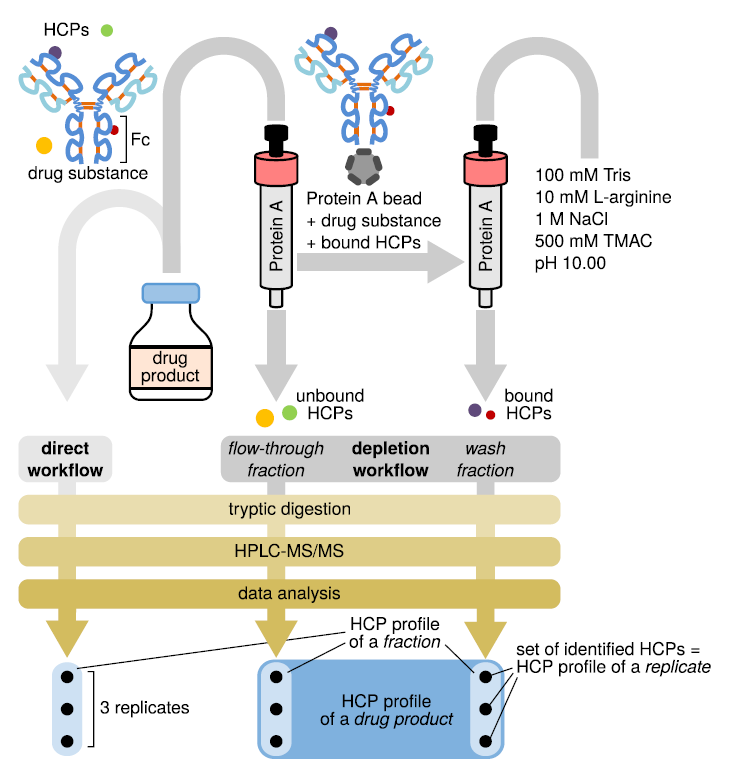
Summary 本简报简述了在蛋白药物产品中的HCP分析挑战。提出了一种用于HCP来源肽段的HPLC-MS/MS 数据评估的改进策略。 在全扫描 MS 水平上,增加了非特征性肽段匹配和序列相近蛋白质的匹配算法,结合基于特征性肽段的碎片离子质谱的鉴定,显著增加了检测到的肽和 HCP 的数量。 Introduction 生物制药的生产中,有部分会涉及到在宿主细胞中表达重组蛋白,然后对该目标蛋白进行纯化。尽管在这个过程中有着严格的纯化程序,但宿主细胞蛋白(HCP) 可能还是会被共同纯化并保留在最终的药物产品中,这就可能会降低产品的安全性和功效。因此,在生物药物的生产和放行过程中,必须使用高灵敏度的分析方法来识别和量化残留的HCP。 高效液相色谱与串联质谱(HPLC-MS/MS) 相结合的方法对于监测HCP 有其特殊的优势,它可以做到对于HCP蛋白信息的注释。 以前的研究倾向于通过实验室前处理步骤的优化来提高可定性到的宿主细胞蛋白的数量,但是,采集到的MS/MS数据却还是使用标准设置来进行分析。在本文中,则采取另一种在分析水平上的改进,基于HCP衍生肽的HPLC-MS/MS数据分析策略。该数据评估流程结合了:(a)基于从碎片离子鉴定到所有肽的概率对蛋白质进行推断与(b)在全扫描MS水平上的肽检测(即使在没有MS/MS的情况下)。我们的方法可以在现有的 HPLC-MS/MS分析流程中,成为可以用于大分子表征以及工艺开发背景下的强有力的分析工具。 Experimental Conditions Esser-Skala等,2020[1]提供了完整的实验细节。 这项工作采购了五种药物产品:单克隆抗体利妥昔单抗(MabThera®) 和贝伐单抗(Avastin®),以及融合蛋白依那西普(不同的2个生产商:Enbrel®生产批次(美国和欧盟)和批准的生物仿制药Benepali®)。所有这些蛋白药物均源自 CHO 细胞中的重组表达。 本次研究分成为两个策略,第一种研究策略是HCP鉴定最基本的分析流程,包括胰蛋白酶酶解、RP-HPLC-MS/MS的谱图分析和针对 CHO细胞数据库的蛋白质鉴定分析,如图1左侧所示。在做酶解之前,将蛋白质β-半乳糖苷酶和β-乳球蛋白添加到样品中。 第二种研究策略是使用了protein-A 亲和Fcdomain-containing therapeutic proteins进行分级的方法,如图1 所示。在纯化前,将蛋白质β-半乳糖苷酶和β-乳球蛋白添加到样品中。收集在therapeutic protein通过protein-A后不同的穿流馏分及洗脱液,并对其进行分析。 在上述样本胰蛋白酶酶解后获得的肽混合物中加入Hi3 标准品,并在配备分流(1:100) 的Thermo Scientific™ UltiMate™ 3000 HPLC 系统和Waters 150×0.30 mm ACQUITY UPLC® CSH™ C18色谱柱上进行三次分析。MS选用的是Thermo Scientific™ Q Exactive™ Plus-Orbitrap 质谱仪。 获得原始数据后,使用Protein Metrics Inc. Byos® v3.4-72-g5fd2d85e63 …
HCP鉴定能力提升方法-最新简报 Read More »