天冬酰胺脱酰胺定量
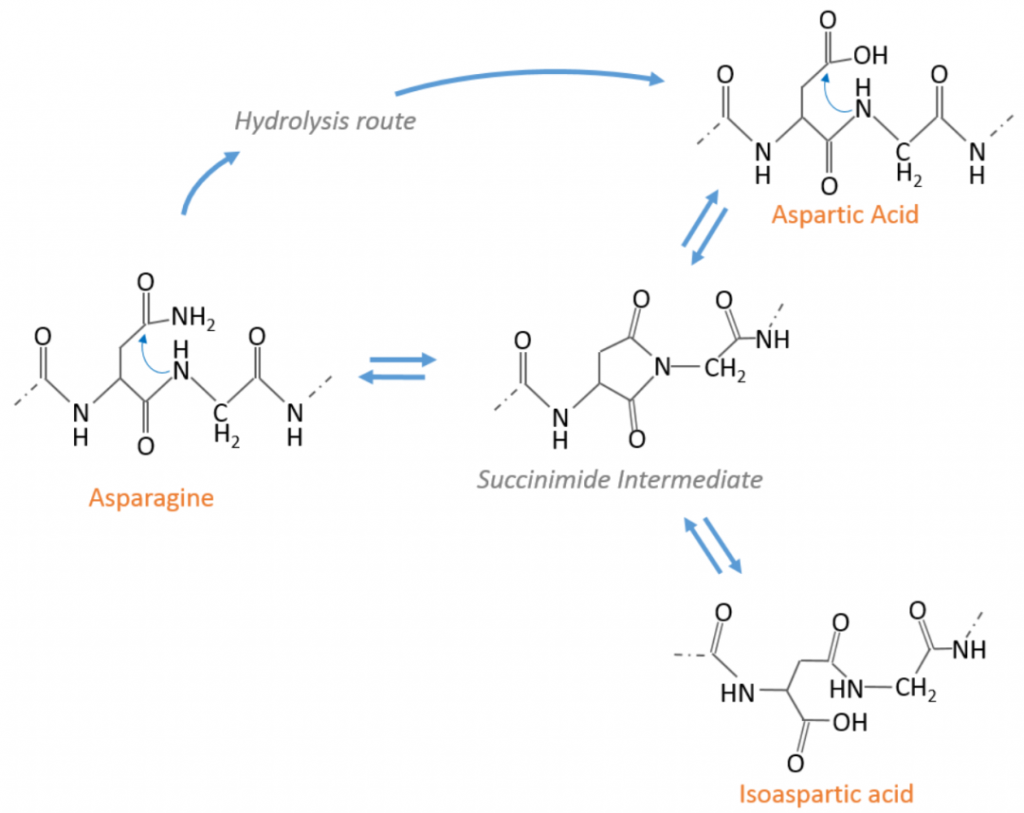
在蛋白质药物中天冬酰胺脱酰胺是一种常见的翻译后修饰,它通常是药物开发过程中实验考察的重点条件。许多研究人员在早期研究阶段会去比较不同候选分子的脱酰胺比例并进行筛选,在研究后期对不同批次产品的脱酰胺比例进行比较。总之,无论是出于内部研究的需要还是监管机构的要求,研究人员都需要对蛋白质药物中的脱酰胺修饰进行准确定量。本期文章为大家简单介绍如何在Byos软件中对脱酰胺修饰进行定性和定量分析。 如图1所示,天冬酰胺脱酰胺主要有两种方式:第一种方式天冬酰胺通过水解反应变为天冬氨酸,第二种方式天冬酰胺首先脱氨形成琥珀酰亚胺,琥珀酰亚胺进一步形成天冬氨酸或者异天冬氨酸。【1】【2】 图1.天冬酰胺脱酰胺的两种方式 当脱酰胺修饰的肽段与未修饰肽段在色谱上有一定程度的共流出时,由于理论上发生脱酰胺修饰的分子量差异是0.984Da,这种情况下很难对脱酰胺的比例进行准确定量。今天我们介绍下Protein Metrics Byos软件针对脱酰胺修饰的去卷积,定量,及最后的报告展示。 我们以IgG1抗体为例,在pH8.5的条件下分别放置1,3,7天。使用Trypsin进行酶切处理,在LTQ-Orbitrap XL(Thermo Fisher)质谱仪上进行数据采集。使用Byos中的PTM workflow对原始数据中的MS/MS谱图进行鉴定,使用肽段的提取离子流图峰面积进行定量。脱酰胺修饰肽段通常会与未修饰肽段发生部分共流出,在Byos的搜索结果中,我们可以方便地对共流出情况进行观测。 图2.发生脱酰胺修饰的…NGQPENNY肽段在Protein Metrics Byos中去卷积前(左)和去卷积后(右)对比图 在图2中左上的提取离子流图实际上是脱酰胺修饰肽段的单同位素峰和未修饰肽段第一个C13同位素峰提取离子流图的总和,右上是在总和的基础上扣除未修饰肽段的结果。 下面我们以IgG1 Trypsin酶切获得的一条常见肽段GFYPSDIAVEWESN387GQPEN392N393YK为例介绍Protein Metrics如何对脱酰胺进行定性和定量。 N392和N393位点脱酰胺分析 为了确认N392位点是否发生脱酰胺修饰,我们在peptide搜索结果中鼠标点击GFYPSDIAVEWESNGQPEnNYK肽段,如图3所示,Byos会在软件对应窗口提供已注释的脱酰胺修饰肽段和未修饰肽段二级质谱图,我们可以用鼠标对图中任意峰进行放大,观察修饰肽段与未修饰肽段碎片例子差异,进而确认修饰位点,从图3可以看出y4离子在脱酰胺肽段与未修饰肽段上有0.984Da差异,进而证明脱酰胺发生于N392位点。 图3.脱酰胺修饰与未修饰GFYPSDIAVEWESNGQPEnNYK肽段已注释二级质谱图 除了提供已注释二级质谱,Byos可以同时提供修饰和非修饰肽段的提取离子流图,如图4所示。图中代表所选二级谱图的保留时间,代表所选肽段其他二级谱图的保留时间,代表与所选肽段具有相同分子量的其他肽段的保留时间。从图上可以看出,Byos共提取出3个脱酰胺相关峰并判定只有保留时间为92.5min的峰为N392脱酰胺修饰。这也与文献报道一致,根据Robinson【1】的报道只有当天冬酰胺的C端为甘氨酸时,会产生中间体琥珀酰亚胺并进一步生成异天冬氨酸和天冬氨酸,所以N392通过水解反应直接生成天冬氨酸。这篇报道同时指出酪氨酸的疏水性会导致天冬氨酸不易产生脱酰胺修饰,这与本研究相符,在N393上并未发现脱酰胺修饰。 图4.脱酰胺修饰GFYPSDIAVEWESNGQPEnNYK肽段提取离子流图 如图5和表1所示,Byos能够对同一project内不同样品的相同位点的修饰比例进行计算,Byos可以使用XICRadio%进行定量,计算公式如下: N387位点脱酰胺分析 …